KİM DEMİŞ! AŞILARIN ÇALIŞMA ŞEKLİ AYNI DİYE…

Hikmet Geçkil’ in yazısı:
Mevcut COVID-19 aşılarının hepsi Spike proteinini bağışıklık sistemine sunar. Ancak, bu sunum çok farklı şekillerde yapılamkat ve dolayısı ile bağışıklık tepksi de oldukça farklı olmaktadır.
COVID-19 aşıları, pandeminin başlangıcından bu yana benzeri görülmemiş bir hızla geliştirildi. Teknik olarak, SARS-CoV-2’ye karşı geliştirilen 8 tip aşı olabilir:

- inaktive edilmiş virüs bazlı aşılar
- replike olmayan vektör bazlı aşıları
- replike olan vektör bazlı aşılar
- subünite (protein alt birimli) aşılar
- virüs benzeri partikül bazlı aşılar
- mRNA bazlı aşılar
- DNA bazlı aşılar
- canlı zayıflatılmış (atenue) aşılar
Ancak şu anda COVID-19 mücadelesinde öne çıkan ve çalışma modları ile farklılık gösteren iki aşı çeşidi var:
- mRNA ve adenoviral vektör bazlı aşılar
- İnaktive edilmiş tam virüs aşıları
Bu üç aşı çeşidi arasında mRNA tipi aşılar insanlarda ilk kez kullanılıyor. Şimdiye kadar ~10 aşı klinik uygulamaya ulaştı ve SARS-CoV-2’ye karşı kullanım için izin verildi.
| Aşının tipi | Üretici firma | Aşının adı | Kararlı kılan mutasyonlar | Virüs suşu | Ökaryotik üretim hücre hattı | Doz |
| mRNA | BioNTech-Pfizer (Almanya, ABD) | BNT162b2, Comirnaty | Evet (prolinler) | Wuhan-Hu-1 | yok | 30 μg RNA (2x) |
| mRNA | Moderna-NIAID (USA) | mRNA-1273, COVID-19 Vaccine Moderna | Evet (prolinler) | Wuhan-Hu-1 | yok | 100 μg RNA (2x) |
| Adenovektör | Oxford Üniversitesi AstraZeneca(İngiltere, İsveç) | COVID-19 aşısı AstraZeneca, AZD1222, ChAdOx1-S, Vaxzeria; Covishield | yok | Wuhan-Hu-1 | HEK293 | adenovirüs vektörü 5×1010 partikül (2x) |
| Adenovektör | CanSino Biological Inc., Pekin Biyoteknoloji Enstitüsü (Çin) | Ad5 nCoV, Convidecia | yok | Wuhan-Hu-1 | HEK293 | adenovirüs vektörü 5×1010 partikül (2x) |
| Adenovector | Gamaleya Research Institute (Russia) | rAd26-S + rAd5-S, Gam-COVID-Vac, Sputnik V | Wuhan-Hu-1 | HEK293 | adenovirüs vektörü 10×1010 partikül (2x) | |
| Adenovektör | Janssen-Johnson & Johnson (NL/ AMERİKA BİRLEŞİK DEVLETLERİ) | Ad26.COV2.S, COVID-19 Aşısı Janssen | evet (prolinler, furin bölünme yeri) | Wuhan-Hu-1 | PER.C6 | adenovirüs vektörü 5×1010 partikül (1x) |
| İnaktif bütün virüs | Sinopharm, Pekin Enstitüsü Biyolojik Ürünler Co (Çin) | BBIBP-CorV, Sinopharm COVID-19 aşısı | yok | Wuhan-Hu-1 benzeri HB02 suşu | Vero | 4 μg önerilen (2x) |
| inaktif bütün virüs | Sinovac (Çin) | CoronaVac | yok | Wuhan-Hu-1 benzeri CN2 suşu | Vero | 3 μg önerilen (2x) |
| İnaktif bütün virüs | Bharat Biotech (Hindistan) | Covaxin, BBV152 | yok | NIV2020-770 (D614G) | Vero | 6 μg önerilen (2x) |
| Subünite | Novavax (ABD) | NVX-CoV2373 | evet (prolinler, furin bölünme yeri) | Wuhan-Hu-1 | Sf9 | 5 μg S ( +50 μg adjuvan) (2x) |
Ancak bu anahtar antijenin bağışıklık sistemine sunumu, farklı aşı kategorileri arasında önemli ölçüde farklılık gösteriyor.
Mevcut COVID-19 aşıları, Spike proteinini bağışıklık sistemine çok farklı şekillerde sunar. Bu sunuma göre şu anda iki ana grup aşı bulunmaktadır. İlk gruptakiler mRNA ve adenoviral vektör aşılarından oluşur (genetik aşılar). Bu aşıların her ikisi de doğrudan Spike proteini içermez. Bunun yerine, Spike proteininin sentezinin komutlarını taşıyan bir genetik biligi molekülü (mRNA) injekte (genel olarak kas dokusuna) edilir. Aşılanan kişinin vücut hücrelerinde (tabi hepsinin kas hücresi olması gerekmiyor) Spike biyosentezi için genetik bilgi protein sentrez aparatlarımız olan ribozmlarda deşifre edilir ve Spike proteini üretilir. Viral vektörlerde bu duruma ek bir adım daha eklenir. Çünkü, bu vektörlere (DNA virüsleri olan adenovirüsler) klonlanan genetik bilgi Spike’ın mRNA’sı değil DNA’sıdır ve ek bir adımda bu DNA’nin hücre çekirdeğine gidip (çekirdk üzerindeki por yani göznekler sayesinde) mRNA’ya yani Spike mRNA’sına dönüşmesi (transkripsiyon) ve bunun da tekrar sitoplazmaya gelip diğer mRNA aşılarındaki gibi proteine deşifre edilesi )translasyonu) gerekir. Bundan sonraki adımlar hem mRNA hem de adenovirüs bazlı aşılar için aynıdır: tüm salgı yolağı boyunca Spike proteini veya parçalarının tesnifi, glikozilasyonu, paketlenemsi, hücre yüzeyinde direkt veya MHC I (tüm hücrlerde) veya MHC II (sadece bağışıklık hücreleri) aracılığı ile diğer bağışıklık hücrelerine sunumu. Bu tür aşılarda, B hücrelerine uygun şekilde katlanmış spike proteinlerinin doğru oluşumu ve sunumu için genetik dizilimlerin spesifik tasarımı ve uygun glikozillenme (antijenik özellik kazandırma) ön plana çıkmaktadır.
İkinci kategori, farklı formlarda ve adjuvanlarla kombinasyonlarda S içeren klasik inaktive edilmiş tam virüs aşıları ve daha yeni olan alt birim (subünite) aşılar gibi protein bazlı aşılardır. Bu aşılarda, antijenik determinantlar (virüslerin proteinleri) doğrudan doğal hallerine yakın ve aynı glkozillenme profilleri ile sunulmaktadır ve ilk karşılaştıkları hücreler, birinci gruptakilerin tersine doku ve kanda kanda yerleşik doğal bağışıklık hücreleridir (makrofaj, nötrofil, nedritik, monosit, doğal katil hücreler gibi).
Doğuştan gelen tepkilerin aşıya özgü farklılıkları
Adaptif (kazanılmış) bağışıklık tepkilerinin spesifik özellikleri, doğuştan gelen tepkiler tarafından güçlü bir şekilde etkilenir ve şekillendirilir. Bu tepkiler, patojenle ilişkili moleküler motifler (PAMP’ler) ve bunların motif tanıma reseptörleri (PRR’ler) tarafından algılanmasıyla tetiklenir. Mevcut COVID-19 aşıları, bileşimleri ve etki biçimleri açısından çok farklıdır. Bu nedenle aşı kaynaklı doğuştan gelen tepkiler önemli ölçüde değişecektir. Adenoviral vektörler, plazma membranında yerleşik bulunan Toll-benzeri resptörleri (TLR2 ve TLR4) ve endozomal olarak yerleştirilmiş TLR9 tarafından algılanabilen PAMP’ler içerir. Ek olarak, viral DNA’nın kendisi, endozomal yırtılmadan sonra cGAS ve enflamzom gibi sitozolik DNA sensörleri tarafından algılanabilir, bu da tip I interferonlar gibi antiviral faktörlerin üretilmesi için akış-aşağı sinyal basamaklarıyla (kaskad) sonuçlanır. mRNA aşıları için bu durum söz konusu değildir.
RNA virüsü enfeksiyonlarında veya mRNA aşılamasında olduğu gibi, hücrelere dışarıdan giren RNA’ya verilen doğal tepkiler, adenovirüsler tarafından uyarılanlardan oldukça farklıdır. Çünkü RNA, tümü endozomlarda bulunan TLR3, TLR7 ve TLR8 dahil olmak üzere diğer PRR’ler tarafından algılanır. Ancak, mRNA’lardaki urasillerin psödourasillere modifiye edilmiş olması bu tepkinin açığa çıkmasına ve önemli sitokinler olan tip 1 interferonların salgılanmasına engel olur.. Retinoik asit ile indüklenebilir gen I (RIG-I) ve melanom farklılaşması ile ilişkili antijen 5 (MDA-5) gibi sitoplazmadaki sensörler, tek zincirli değil tercihen çift zincir RNA’yı tanır ve ayrıca tip I IFN salgısının uyarılmasına yol açar. Bu nedenle aşırı doğal tepki, yalnızca aşılamanın güçlü reaktojenitesi ile sonuçlanmakla kalmaz, aynı zamanda aşı RNA’sından antijen translasyonunu kısıtlayarak, adaptif bağışıklık tepkilerini de bozar. Bu sorunun üstesinden gelmek için, BioNTech-Pfizer ve Moderna aşılarında, RNA dizisinin tüm urasillerini, psödo (sahte) urasile (m1Ψ) değiştirmişlerdir. RNA tarafından doğuştan gelen bağışıklığın doğrudan tetikleyicilerine ek olarak, LNP’lerin diğer bileşenleri aşı kaynaklı enflamatuar reaksiyonlara katkıda bulunabilir ve adaptif bağışıklık tepkileri için adjuvan aktivitesi sağlayabilir. Bu tür etkiler, LNP’lerdeki iyonlaşabilir lipid bileşeni için özel olarak gösterilmiştir.
Doğuştan gelen tepkileri uyarma kapasiteleri nedeniyle, genetik aşılara “kendiliğinden adjuvanlanmış” denir. İnaktive edilmiş tam virüs aşıları veya alt birim aşıları gibi protein bazlı aşılar genellikle kendi başlarına yeterince immünojenik değildir ve adjuvanların eklenmesini gerektirir. Şap (Alum tuzu), insan aşılarında en sık kullanılan adjuvandır ve Sinopharm ve Sinovac aşılarında kullanılır.
Detay istersen ….
Aşıların hepsi, SARS-CoV-2’nin doğal viral spike proteinine (S) hedefliyor…

Aşılamanın temel amacı, doğuştan gelen bağışıklığın katılımıyla SARS-CoV-2’ye karşı antikor ve spesifik T-hücre yanıtları şeklinde koruyucu adaptif (kazanılmış) bağışıklık oluşturmaktır.
Nötralize edici antikorlar, hem S1 hem de S2 üzerindeki bölgeleri (domeynleri) hedefler. S1 veya S2 proteinlerine özgü antikorlar, SARS-CoV-2’nin konakçı hücreye bağlanmasını (S1) ve füzyonunu (S2) bloke edebilir. Bu nedenle, nötralize edici antikorlar viral klirenste önemli bir rol oynar. S1 veya S2’ye özgü bu antikorların üretimi, gelecekteki COVID-19 enfeksiyonuna karşı korunmaya yardımcı olabilir. SARS-CoV-2 viral spike proteinine karşı antikorların nötralize edici etkileri olduğu gösterilmiştir.
S proteini yarı kararlı bir prefüzyon yapıda bulunur ve proteolitik bölünme (bizim sağladığımız protezlarla) proteini daha kararlı, füzyon sonrası bir duruma yeniden katlar.
S proteinlerine karşı antikor üretimi, IgM, IgG (esas olarak IgG1 ve IgG3) ve IgA sınıfları yönünde olur. Bu antikorların seviyeleri, sırasıyla IgM ve IgG/IgA için aşılamadan 14 ve 28 gün sonra zirve yapar. Bu antikorların serum konsantrasyonları, aşıları ve enfeksiyonları değerlendirmek ve takip etmek için ölçülebilir.
Bu antikorların potensi (etkinlik durumu), doğal bir konformasyonda Spike’ın S1 al biriminin karmaşık üç boyutlu yapısının belirli kısımları ile yüksek afiniteli etkileşimlerine bağlıdır. B hücreleri tarafından bu tür antikorların etkin oluşumu, MHCII molekülleri (sadece bağışıklık hücreleri üzerinde bulunur ve MHC I komplkeslerine göre daha büyük antijen paraçalrı sunar) ile kompleks halinde aynı antijenden türetilen peptitler tarafından spesifik olarak uyarılan CD4 T hücrelerinin yardımcı işlevlerini gerektirir. Sitotoksik (enfekte hücreleri öldüren) CD8 T hücreleri gibi hücresel bağışıklığın diğer bileşenleri de SARS-CoV-2 enfeksiyonu veya aşılamasından sonra bağışıklık tepkilerine katkıda bulunur, ancak bunların COVID-19 enfeksiyonlarındaki ve hastalıktan korunmadaki rolleri hala tam olarak net değildir.
Aşılamadan sonraki CD4+ T-hücresi yanıtı, gama-interferon, tümör nekroz faktörü-alfa ve interlökin (IL)-2 üretebilir. CD8+ T hücreleri de aşılar tarafından aktive edilir. Ne yazık ki, T-hücre yanıtlarının ölçümü antikorların ölçümü kadar kolay değildir ve sadece bu konuda uzman laboratuvarlada mümkündür (T-hücre durumu, doğrudan Th1 aktivitesini ölçen INF-ELISpot ile ölçülebilir).
S’nin biyosentezi
Hücresel SARS-CoV-2 enfeksiyonu sırasında (Şekil 1a), S proteini viral subgenomik mRNA’lardan birinden sentezlenir ve bir sinyal kullanılarak endoplazmik retikulumun (ER) lümenine eş-translasyonel olarak taşınır. toplam 1273 amino asidinin 1 ila 13 kalıntılarını içeren N-terminalindeki dizi. Sinyal dizisi, iç ER zarına bağlanan sinyal peptidazı tarafından bölünerek viral başak proteininin (14-QCVNL…) son N-terminalini oluşturur. Translasyonun tamamlanmasından sonra, protein bir C-terminal membran bağlantısı aracılığıyla ER membranına bağlı kalır, trimerize olur ve virüsün ERGIC lümenine tomurcuklanarak oluştuğu ER-Golgi ara bölmesine (ERGIC) hareket eder (Şekil 1a). Ekzositoz sırasında, virüs partikülleri, S proteinini membranla ilişkili S2 alt birimine ve karakteristik bir polibazik bölünme yerinde distal S1 alt birimine ayıran trans-Golgi ağındaki (TGN) proteaz furin ile karşılaşır.
Bu alt birimler, kovalent olmayan yollarla trimerde ilişkili kalır. etkileşimler ve virüs muhtemelen bozulmuş lizozomal fonksiyonlar17 ile ekzositik lizozomlar yoluyla salgılanır. N- ve O-glikosilasyon ile kapsamlı modifikasyonlar, hücre içi taşınması sırasında S’nin karşılaştığı bölmelerde meydana gelir.
S, izole edilmiş bir protein olarak sentezlendiğinde (mRNA ve adenovirüs vektör aşılarında ve ayrıca rekombinant alt birim aşılarının üretiminde olduğu gibi), biyosentez yolu çok benzerdir. Bununla birlikte, partikül montajı için diğer viral bileşenlerle etkileşimlerin olmaması, glikosilasyonu modüle edebilir.
S trimerlerin motifi ve kararlılığı
Ayrıca, S1, TGN’de furin bölünmesinden sonra (dökülme) rekombinant olarak üretilen sivri uçlardan ayrılabilir ve bölünme bölgesini ortadan kaldıran mutasyonların yokluğunda S2’nin füzyon sonrası konformasyonuna dönüşmesine izin verebilir. Otantik viral sinyal dizisinin manipülasyonları, N-terminalinin homojen olmamalarına neden olabilir ve S’in doğal katlanmasını bozabilir.
S’nin her monomeri birkaç yapısal elemandan oluşur: doğal S trimerindeki S2 parçasını kapatan S1’deki N-terminal alanı (NTD) ve reseptör-bağlama alanı (RBD). RBD, bir “yukarı” ve “aşağı” konum arasında gider gelir. Hücresel reseptör (ACE2) ile etkileşim, yalnızca geçici olarak açığa çıkan RBD “yukarı” konumdayken mümkündür. Olgun formunda, S trimer yarı kararlıdır ve tetiklenen konformasyonel değişikliklere uğramaya hazırdır. Bu değişiklikler, S2’nin virüs girişi üzerine viral ve hücresel membranların füzyonunu yürütmesine izin verir. Tetik, RBD’nin ACE2’ye bağlanmasını içerir. Sözde S2′ bölgesinde hücresel proteazlar tarafından (S1 ve S2 arasındaki furin bölünmesine ek olarak) başka bir proteolitik bölünme, küçük bir dizi elemanının çıkarılmasıyla ve füzyon peptidinin N-terminalinde açığa çıkmasıyla sonuçlanır. S2. Bu değişikliklerin bir sonucu olarak, S1 alt birimleri trimerden ayrışır ve S2’yi füzyon öncesi konformasyondaki kısıtlamalarından kurtararak karakteristik uzun füzyon sonrası yapıya geri dönüşü olmayan bir dönüşüme izin verir. Füzyon peptitinin C-terminal membran çapasına yan yana getirildiği bu saç tokası benzeri yapının oluşumuyla kazanılan enerji, giriş sırasında viral membran füzyonunun itici gücüdür.
S trimerin farklı konformasyonları benimseme potansiyeli, aşılarda kullanımı için bir sorun teşkil edebilir. Çünkü doğal yapı (güçlü olarak nötralize edici antikorları indüklemek için gerekli), geleneksel aşıların üretimi sırasında veya genetik aşılamadan sonra protein aşılananın hücrelerinde ifade edildiğinde bozulabilir. Bu nedenle bazı üreticiler, kararsız S proteininin yanlışlıkla yapısal dönüşümünü önlemeyi amaçlayan stabilize edici mutasyonlar sunmuştur. Bu modifikasyonlar, füzyon sonrası formda füzojenik konformasyonel geçişlerini uzun bir alfa sarmalına dönüştürmek için füzyon öncesi formdaki iki alfa-helis arasındaki bağlantıda S2’deki (K986P ve V987P) iki prolin mutasyonunu içerir. Ayrıca, prefüzyon trimerini korumak ve S1’in dökülmesini önlemek için S1 ve S2 arasındaki furin bölünmesini ortadan kaldıran mutasyonları içerir.
S’nin antijenik yapısı
S (veya parçaları) ve antikor Fab fragmanları arasındaki komplekslerin 3D yapı belirlemeleri dahil, COVID-19 hastalarından bir dizi monoklonal antikor izole edildi ve S trimerinin antijenik karakterizasyonu için kullanıldı. Toplu olarak bu veriler, en güçlü nötralize edici antikorların RBD’ye özgü olduğunu gösterdi. Ancak birkaç güçlü nötrleştirici antikor da NTD’yi tanıdı ve bazıları trimerin kuaterner düzeneğine bağlıydı. S2’ye karşı antikorlar için de nötralize edici aktivite gözlendi, ancak potens, S1’e karşı olanlardan daha düşüktü. SARS-CoV-2 enfeksiyonundaki insan nötralize edici antikor yanıtına, RBD’ye özgü antikorların hakim olduğu görülmektedir. Bu antikorların, insan enfeksiyon sonrası serumlarının toplam nötralize edici aktivitesinin %90’ına katkıda bulunduğu gösterilmiştir. Bu nedenle, tüm COVID-19 aşılarının ana hedefi, aşılamadan sonra yüksek oranda güçlü nötralize edici antikorları indüklemek için Spike proteini ve onun RBD’sini en doğal konformasyonda sunmaktır.
Spike’ın Antijenik Yapısı ve Sunumunun Aşıya Özgü Farklılıkları

Hâlihazırda mevcut olan COVID-19 aşıları, etki biçimleri ve Spike antijenin bağışıklık sistemine sunulma biçimleri açısından temel farklılıklar göstermektedir.
Genetik aşılar
Mevcut genetik COVID-19 aşılarının ortak özelliği, kas içi uygulamadan sonra Spike proteinin tamamı için mRNA’ların sağlanmasıdır. RNA aşıları, doğrudan S proteinine çevrilebilen tamamen işlevsel mRNA’lar içerirken, vektör DNA’nın RNA’ya çekirdek (nukleus) içi transkripsiyonu ve fonksiyonel mRNA’lar üretmek için işleme dahil olmak üzere adenovirüs vektör aşıları ile ek biyosentetik adımlar gereklidir. Kas hücrelerinin, fibroblastların, endotel hücrelerinin ve/veya dendritik hücreler gibi bağışıklık hücrelerinin, kas içi aşılamadan sonra S ifadesine katkıda bulunduğuna inanılmaktadır (ancak bu durum sistematik olarak çalışılmamış ve deneysel olarak gösterilmemiştir). Güçlü nötralize edici antikorların üretimi, büyük olasılıkla S-ifade eden hücrelerin plazma membranına demirlenen Spike protein parçalarının tanınmasıyla, B hücrelerinin doğal protein ile etkileşimini gerektirir. Buna karşılık, CD8 ve CD4 T hücreleri, sırasıyla MHCI ve MHCII ile peptit kompleksleri (proteolitik işlemden sonra hücre içi S’den türetilmiştir) tarafından uyarılır.
a. mRNA aşıları
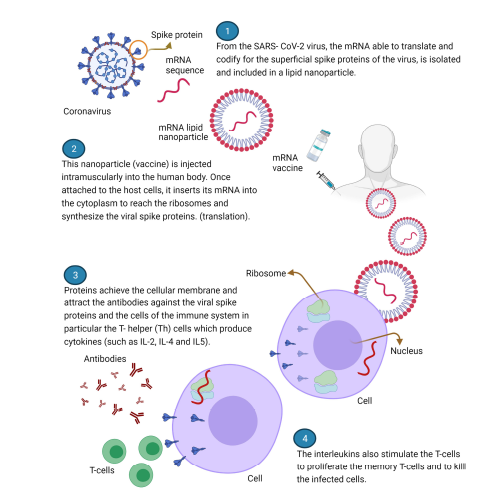
Mevcut yaygın uygulamadaki iki mRNA aşısı (BioNTech-Pfizer ve Moderna) teknolojik olarak çok benzerdir. Tam uzunluktaki S proteininin verimli ifadesi için kodon optimize edilmiş diziler içerirler ve biyosentezi için otantik sinyal dizisini kullanırlar. Her iki yapı da, S2’deki (K986P ve V987P) iki kararlı kılıcı mutasyon içerir ve bunların, Spike’ın füzyon öncesi (pre-fuzyon) yapısının, füzyon sonrası (post-fuzyon) yapıya değişimini önlediği gösterilmiştir.
Aşı mRNA’larının üretim süreci, mRNA’ya karşılık gelen bir DNA dizisi ve DNA bağımlı bir RNA-polimeraz promotörü içeren bir plazmitin klonlanmasını içerir. Bakteri hücrelerinde çoğaltıldıktan sonra, plazmit DNA’sı lineerleştirilir ve oratmadaki kontaminantlar (safsızlıklar) çıkarıldıktan sonra in vitro (hücre gerketirmeyen) bir ortamda mRNA’ya çevirilir (transkripsiyon). Bu mRNA’ya 5′ kapak (şapka) yapısının eklenmesi, büyük ölçekli üretime uygun yeni teknoloji ile geliştirilmiş bu üretim adımının kritik bir parçasıdır. In vitro transkripsiyonu, doğal aşırı bir bağışıklık tepkisine ve eşlik eden reaktojenisiteye yol açabilecek çift zincir RNA’nın çıkarılması dahil olmak üzere birkaç mRNA saflaştırma aşaması takip eder. Her iki mRNA aşısının da mRNA kararlılığını ve translasyon etkinliğini optimize etmek için 5′ ve 3′ çevrilmeyen (UTR) dizileri modüle edilmiştir ve RNA kararlılığını daha da artırmak ve doğuştan gelen bağışıklık tepkilerini azaltmak için tüm üridinler N1-metilpsödouridin (m1Ψ) ile değiştirilmiştir.
Uygulama için, RNA aşıları, lipit nanopartikülleri (LNP) formundaki spesifik lipitlerle kompleksler halinde formüle edilir, bunlar sadece dokularda RNA bozulmasına karşı koruma sağlamakla kalmaz, aynı zamanda RNA translasyonu için hücre içine alımını ve sitoplazmaya salınımını da kolaylaştırır.
b. Adenovirüs-vektör aşıları

mRNA aşılarıyla karşılaştırıldığında, adenovirüs-vektör aşıları memeli hücre kültürlerinde üretim dahil birkaç ek karmaşıklık katmanı içerir. Bunlar, immün reaksiyonların heterojenliğine ve yan etkilere yol açabilir. Varyasyonlar, bir vektör olarak kullanılan adenovirüs tipini, vektörün genetik modifikasyonlarını, aşı üretimi için kullanılan hücre memeli hatlarını, saflaştırma prosedürlerini ve S’yi ifade etmek için genin spesifik tasarımı gibi birçok değişkeni içerir.
Şu anda dört adenovirüs-vektör aşısı yaygın olarak kullanılmaktadır. Bunlar:
- CanSino Biological Inc./Beijing Institute of Biotechnology
- Janssen-Johnson&Johnson
- Oxford-AstraZeneca
- Gamaleya Enstitüsü Moskova
Üreticiler, vektör olarak farklı adenovirüslerin türevlerini kullanıyorlar: CanSino insan adenovirüs 5’i, Janssen-Johnson&-Johnson insan adenovirüsü 26’yı, Oxford-AstraZeneca şempanze adenovirüsü Y25’i; Gamaleya Enstitüsü, ilk doz için insan adenovirüs 26’yı ve ikinci aşılama dozunda insan adenovirüsü 5’i kullanmaktadır.
Mevcut tüm adenovirüs-aşı vektörlerinin ortak özelliği, adenoviral DNA’daki erken adenoviral genlerden birinin (E1) tam uzunluktaki SARS-Cov-2 S geni için değiştirilmesi ve E3 geninin tamamen silinmesidir. E1 geninin olmayışı, vektörün replikasyon yeterliliğini ortadan kaldırır. Bu nedenle, aşı olarak tasarlanmış partiküllerin üretimi için ölümsüzleştirilmiş yardımcı hücre hatları kullanılır. Bu hücre hatları, kromozomal DNA’larında E1 genini içerir ve eksik işlevi sağlarlar. Bu durum, yapısal proteinlerin biyosentezine, modifiye edilmiş genomik DNA’nın replikasyonuna ve son olarak hücrelerde replikasyon yetersiz virüs partiküllerinin bir araya getirilmesine izin verir.
Oxford-AstraZeneca, Gamaleya ve CanSino aşıları için üretim hücre hatları, primer insan embriyonik böbrek hücrelerinden (HEK293) ve Janssen aşısı için insan embriyonik retina hücrelerinden elde edilir. Adenoviral vektör partiküllerinin eldesi, hücrelerin deterjanlar tarafından parçalanmasını ve hücresel bileşenlerin ve serbest viral DNA’nın çıkarılması için ek işlemler içerir. Son olarak doz başına en az 5 × 1010 partikül içeren aşıların saflığını ve kalitesini etkileyen bu işlemlerin ayrıntıları yayınlanmış literatürde ne yazık ki erişilebilir değildir.
mRNA aşılarına benzer şekilde, adenovirüs vektör aşıları, aşılanan kişinin hücrelerinde belirli bir mRNA’dan doğal S proteinlerinin üretilmesine yöneliktir. Bununla birlikte, bu mRNA’ya giden yol, mRNA aşılarından önemli ölçüde daha karmaşıktır, çünkü adenoviral DNA’nın ekstrakromozomal kaldığı yer olan çekirdek gibi bir yeri de fazladan kapsar ve RNA transkripsiyonu ve işlenmesi dahil olmak üzere bir dizi ek hücresel işlem gerektirir.
Dört adenovirüs-vektör aşısının tüm yapıları, tam uzunlukta Spike proteini içermesine rağmen, yapı tasarımında, S’yi kararlı kılmak için mutasyonların yanı sıra S’nin N-terminalindeki sinyal peptidi açısından bazı farklılıklar vardır. Sadece Janssen aşısı S’i kararlı kılıcı mutasyonlar içerir. Bu aşı sadece S2’deki iki prolini değil, aynı zamanda furin bölünme bölgesinde mutasyonlar (682. pozisyondan 685. pozisyona kadar olan RRAS’ın SRAG’ya değişimi) içerir. Her iki modifikasyonda, S’nin füzyon sonrası yapıya dönüşmesinin önlemesi amaçlanmıştır.
S’nin son N-terminalini oluşturmak için sinyal peptidaz tarafından sinyal peptidinin doğru işlenmesi, doğal katlanmış S’i elde etmek kritik öneme sahiptir. Çünkü furin bölünme bölgesinin hemen iki amino asit aşağısında bir sistein vardır ve bu sisteinin, 136 konumundaki sistein ile S-S bağ oluşturması gerekir. Janssen-Johnson&Johnson ve Gamaleya-Institute, otantik SARS-CoV-2 S protein sinyal dizisini kullanırken, CanSino bunu bunun yerine insan dokusu plazminojen aktivatörü (tPA) kullanmaktadır.
MERS-CoV ile yapılan önceki bir çalışmaya dayalı olarak, Oxford-AstraZeneca aşısı otantik S protein sinyal dizisinin önünde tasarlanmış tPA sinyal dizisinin genişletilmiş bir biçimini kullanır. ChAdOX1-S aşısındaki tasarlanmış “lider dizinin” ayrıntılarını izlemek zordur, ancak muhtemelen 32 ila 34 amino asit tPA içerir ve sinyal peptidaz ile işlenmeyi kolaylaştırmak için 22 konumunda bir P’den A’ya bir mutasyonu içerebilir. Uzatılmış N-terminal ‘lider dizisi’, araya giren bir tPA propeptidi uzantısı ile ayrılan iki ardışık sinyal peptidi ile sonuçlanır. Bu karmaşık yapay dizi elemanı, proteolitik işlemede bir miktar homojenlik kaybına ve biyosentez sırasında S’in N-terminalinin doğru oluşumunun bozulmasına yol açabilir.
Genetik aşılarda, çözünür S1’in trimer (üçlü) kompleksinden ayrılmasının bağışıklık tepkilerinin kalitesi üzerindeki etkisi tam olarak anlaşılmamıştır. Ancak bazı veriler, nötralizan antikorlara göre daha yüksek bir oranda nötralize etmeyen antikor bulunabileceğini düşündürmektedir. Hayvan deneyleri, adenovirüs-vektör DNA’sının, hızla bozunan RNA’nın aksine, aşılamadan aylarca sonra transkripsiyonel olarak aktif formda kalabileceğini göstermiştir. Antijen ifadesinin kalıcılığı, adenovirüs vektör aşılarının ayırt edici bir özelliği olabilir ve sürekli bağışıklık tepkilerinin indüklenmesine ve uzun süreli bağışıklığa katkıda bulunduğu öne sürülmüştür.
İnaktif aşılar
Çinli şirketler olan Sinopharm ve Sinovac tarafından üretilen iki “inaktive tam virüs aşısı” için üretim süreci hakkında yayınlanmış bilgiler mevcuttur. Her iki durumda da virüs, Vero hücrelerinde (Afrika yeşil maymunu böbrek epitel hücreleri) çoğaltılır ve betapropiolakton (BPL) ile inaktive edilir. BPL, kuduz aşıları da dahil olmak üzere diğer viral aşılar için inaktive edici bir ajan olarak kullanılmaktadır. Literatür verileri, Sinovac aşısının üretiminin, esas olarak viral proteinleri içeren ve esasen saf viral partiküllerden oluşan bir ürüne yol açan birkaç virüs saflaştırma aşamasını içerdiğini göstermektedir. Sinopharm aşısının saflık derecesi daha az bilinmektedir. Her iki aşı da adjuvan olarak alüminyum hidroksit kullanır. Benzer teknolojiyi kullanan bir başka inaktive edilmiş tam virüs aşısı, Hintli şirket Bharat tarafından üretilmektedir.
Formalin ile inaktive edilmiş virüsle yapılan yapısal çalışmalarda doğal trimerik füzyon öncesi konformasyonun korunması gözlemlenmiştir, bu da inaktivasyon ve/veya saflaştırma prosedürlerinin S’nin füzyon öncesi ve sonrası konformasyon oranlarını ve dolayısıyla inaktive edilmiş tüm bir virüsün niteliklerini etkileyebileceğini düşündürmektedir. Bu tür faktörler, mevcut inaktive edilmiş tam virüs aşıları ile yapılan klinik deneylerde bildirilen etkililiklerdeki farklılıklara sebep olabilir. Pandemide daha sonra ortaya çıkan örneğin S’de D614G mutasyonunu içeren virüs suşlarının daha kararlı olabileceğine ve bu nedenle inaktive aşıların üretimi için geliştirilmiş bir substrat olarak hizmet edebileceğine dair dolaylı kanıtlar vardır. Bharat tarafından üretilen aşı, bu mutasyonu içeren bir virüs dayanmaktadır.
Aşıların İmmunojen Yapıdan Bağımsız Ayırt Edici Özellikleri
Mevcut aşılar arasında S’nin yapısını ve bağışıklık sistemine sunumunu etkileyebilecek önemli farklılıklar bulunmaktadır. Bu tür antijenik etkilerin dışında, farklı etki mekanizmaları ve üretim yollarından dolayı bağışıklık tepkilerinin ve olası olumsuz reaksiyonların oluşması muhtemeldir. Adenovirüs-vektör ve mRNA aşıları, büyük ölçüde farklı doğuştan gelen tepkileri destekler. Bunlar kesinlikle adaptif bağışıklık tepkilerinin doğasını etkileyecektir. Oxford-AstraZeneca aşısının daha yüksek seviyelerde spesifik T hücrelerini indükleyebileceğine, mRNA aşılarının ise daha yüksek antikor titrelerine neden olabileceğine dair kanıtlar vardır. Bu farklılıkların koruma açısından önemi henüz net değildir.
İmmünojen dışındaki aşı bileşenlerine bağlı reaksiyonlar
Halihazırda, Oxford-AstraZeneca ve Janssen adenovirüs vektör aşıları ile aşılamadan sonra serebral venöz sinüs trombozu dahil olmak üzere “trombotik” olay riskinde hafif fakat önemli ölçüde artmış bir risk rapor edilmiştir ve bu önemli ölçüde endişe uyandırmıştır. Toplu olarak, bu tür bir yan etki olayı, ‘aşı kaynaklı immün trombotik trombositopeni’ (VITT) olarak adlandırılır. Altta yatan patojenik mekanizmaları aydınlatmak için ChAdOx1 nCoV-19 aşısının gelişmiş analizleri, viral DNA ve/veya hücresel proteinler gibi bileşenlerin trombosit faktör 4’e (PF4) karşı antikor oluşumunu ve böylece VITT’yi destekleyebileceğini düşündürmektedir. Hücresel safsızlıklar hakkındaki bilgiler şu ana kadar ChAdOx1 ile sınırlıdır ve tüm adenovektör aşılarının karşılaştırmalı analizleri henüz mevcut değildir.
MRNA aşıları ile aşılamadan sonra, büyük ölçüde alerji öyküsü olan bireylerde, popülasyondaki ortalama insidansın üzerinde nadir görülen “anafilaktik şok” olayları bildirilmiştir. Alerjenlerin çoğu, kimyasal olarak tanımlanmış bu aşılarda bulunmayan proteinlerdir. Anafilaksiye neden olduğu tartışılan bileşenlerden biri, RNA’yı koruyan ve hücrelere transferini kolaylaştıran LNP’lerin formülasyonunda kullanılan polietilen glikoldür (PEG). Önceden var olan PEG antikorlarının bu alerjik olaylarda rol oynayabileceği tahmin edilmektedir. Aşıya bağlı anafilaktik reaksiyonların mekanizmalarına ilişkin bilimsel araştırmalar devam etmektedir.
Vektör bağışıklığı
Vektöre karşı önceden var olan ve aşılama kaynaklı bağışıklığın etkileri, adenovirüs vektör aşılarının özel bir özelliğidir. Toplumlarda adenovirüs vektör gelişiminin öncüsü adenovirüs 5’e karşı yüksek seropozitiflik oranları bildirilmiştir ve bir dizi çalışma, önceden var olan vektör bağışıklığının aşı antijenine yanıtı bozabileceğini göstermiştir. Adenovirus 5, CanSino (AD5-nCOV, ticari adı Convidecia) aşısında ve Gamaleya (Sputnik V) aşılarının ikinci dozunda kullanılmaktadır. Önceden var olan bağışıklığın potansiyel olumsuz etkilerini azaltmak için, alternatif adenovirüsler vektör olarak geliştirildi, bunlardan biri popülasyonda daha düşük seropozitiflik oranlarına sahip olan ve Janssen-Johnson&Johnson aşısında ve Gamaleya Enstitüsü aşısı ilk dozunda kullanılan adenovirüs 26’dır. Vektör bağışıklığına ilişkin bu düşünceler, şimdi Oxford-AstraZeneca aşısında kullanılan şempanze adenovirüs Y25’ten türetilen ChAdOx1 gibi insanda olmayan adenovirüs vektörlerinin geliştirilmesine de yol açtı.
Önceden var olan bağışıklığa bakılmaksızın, tüm adenovirüs vektör aşıları, vektör parçacıklarına karşı bağışıklık tepkilerini indüklemeye meyillidir. Her doz, 8 veya 16 µg adenoviral proteine karşılık gelen 5×1010 veya 10×1010 adenoviral partikül içerir. Anti-vektör tepkilerinin gelecekte gerekli olan COVID-19 güçlendirici aşılar üzerinde hangi etkilerin olacağı şu anda belirsizdir. Olası çözümler, Gamaleya-Institute aşısı (Ad26 ve ardından Ad5) veya mRNA aşıları gibi diğer aşı sınıflarıyla kombinasyonlar ile aşılama için halihazırda kullanılan prime-boost rejimleridr.




Kaynaklar (kısaltılıp, değiştirilerek):
- Antigen Presentation of mRNA-Based and Virus-Vectored SARS-CoV-2 Vaccines
- Could live attenuated vaccines better control COVID-19
- Distinguishing features of current COVID-19 vaccines- knowns and unknowns of antigen presentation and modes of action
- Overview of the Main Anti-SARS-COV-2 Vaccines: Mechanisms
- Immunological mechanisms of vaccine-induced protection against COVID-19 in humans
- A Summary of the SARS-CoV-2 Vaccines and Technologies Available or under Development
- SARS-CoV-2 Vaccines Based on the Spike Glycoprotein and Implications of New Viral Variants
- SARS-CoV-2 vaccines- Lights and shadows

















Çok güzel bir özet olmuş.
Bunu laboratuarında Özgül T hücre cevabı bakabilen immünoloji profesörünün anlayabileceğini ümid ediyorum (?).
Ehemmiyetine binaen mRNA kararlılığının arttırılması için urasil yerine konulan psödouridine dikkatinizi çekmek isterim.
Uzun vadeli genotipik ve fenotipik tesirlerinin ne olacağı meçhuldür.
Bu genetik çorbaların yaygın olarak uygulanması hukuki olması mümkün değildir.
Dünyaca ünlü yazar Noam Chomsky:
“Aşılar işe yarıyorsa, aşısız insanlar nasıl oluyor da aşılı insanlar için bir tehdit oluşturuyor? Aşılar işe yaramıyorsa, neden zorunlu kılıyorsunuz?